Estudiamos el efecto de los PAMs en diferentes modelos de lípidos a través de experimentos de fuga de liposomas, fluorescencia intrínseca de lípidos, péptidos o fluoróforos extrínsecos, mediciones de potencial de membrana, experimentos electrofisiológicos, microscopía avanzada, experimentos de monocapa de Langmuir y dinámica molecular, por nombrar algunos. La mayoría de estos enfoques han arrojado luz sobre los mecanismos de acción de muchos PAMs.
Modelos de Liposomas.
Dispersión de Luz Dinámica.
Fluidez de Membrana.
Estudios Monocapa de Langmuir.
Microscopía de Fuerza Atómica.
Electrofisiología
Simulación de Dinámica Molecular
Mostrar Toda la Información.
Liposomas
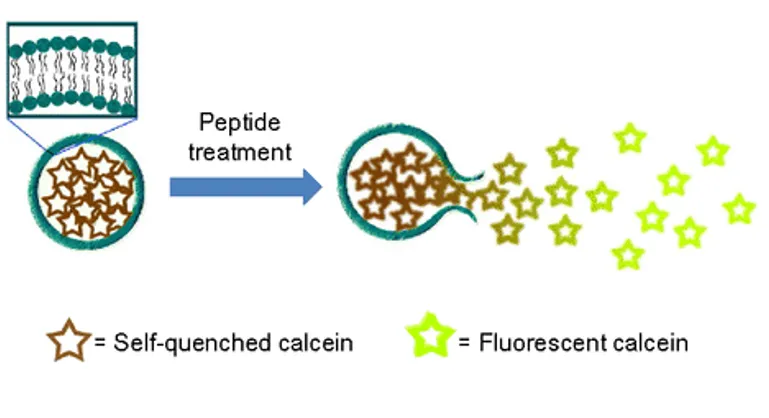
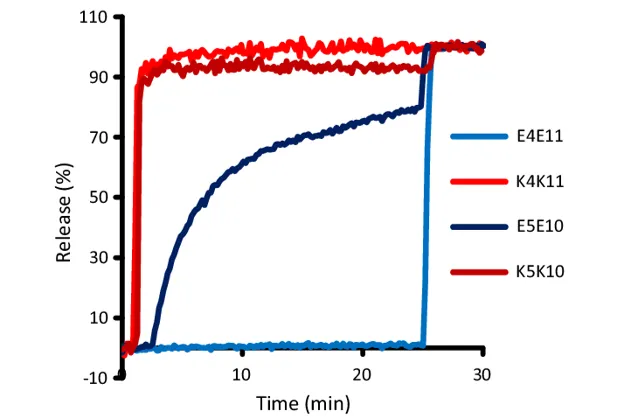
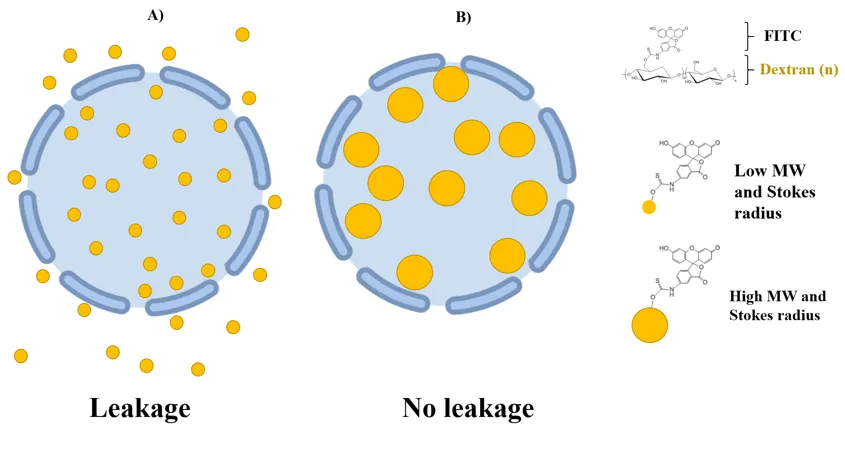
La fuga convencional de experimentos con colorantes fluorescentes encapsulados dentro de liposomas unilaminares se pueden interpretar como la capacidad de formar canales o poros (permeabilización de la membrana) en la membrana citoplasmática, y por lo tanto, el mecanismo de muerte ambiguo pero elemental de PAMs.
Estimación de tamaño de Poros
Prácticamente cualquier colorante impermeable a la membrana que presente autoapagamiento de su fluorescencia a concentraciones relativamente altas, y que presente el fenómeno de fluorescencia a bajas concentraciones (diluido) se puede utilizar en ensayos de liberación de liposomas.
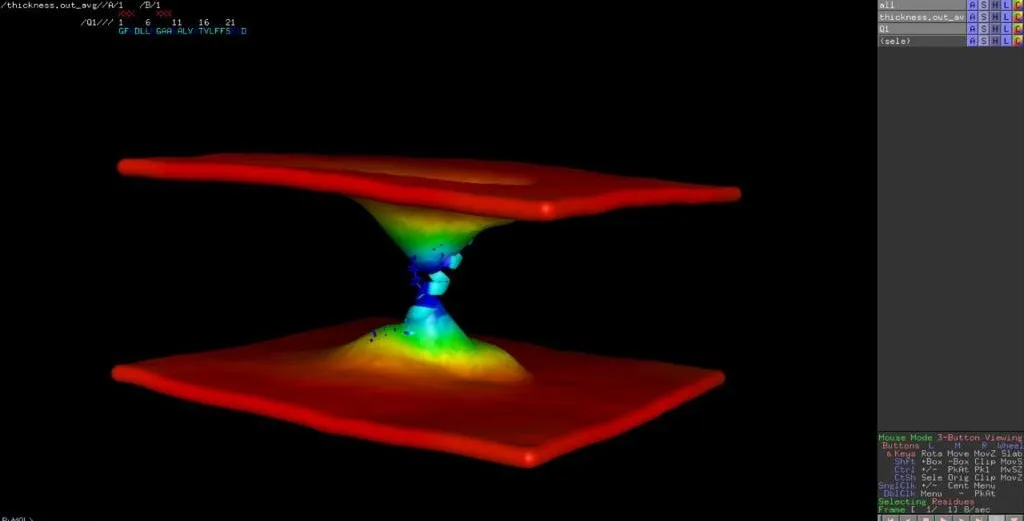
A parte de dar indicios de perturbación de membranas, hay moléculas fluorescentes que permiten estimaciones aproximadas de los rangos del tamaño de los poros formado en membranas.
Las sondas conjugadas fluorescentes como los derivados de dextranos con isotiocianato de fluoresceína (FITC) varían de 4 a 150 kDa, con radios de Stokes aproximados de 14 a 85 Angstroms, respectivamente.
El tamaño de poro determina la fuga de colorante de liposomas por la relación que tiene con el tamaño del conjugado. Por ejemplo, el conjugado FITC-dextrano de 40 kDa solo se filtrará a través de un poro mas grande de 9nm en diámetro.
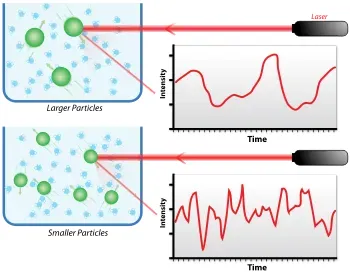
Dispersión Dinámica de Luz
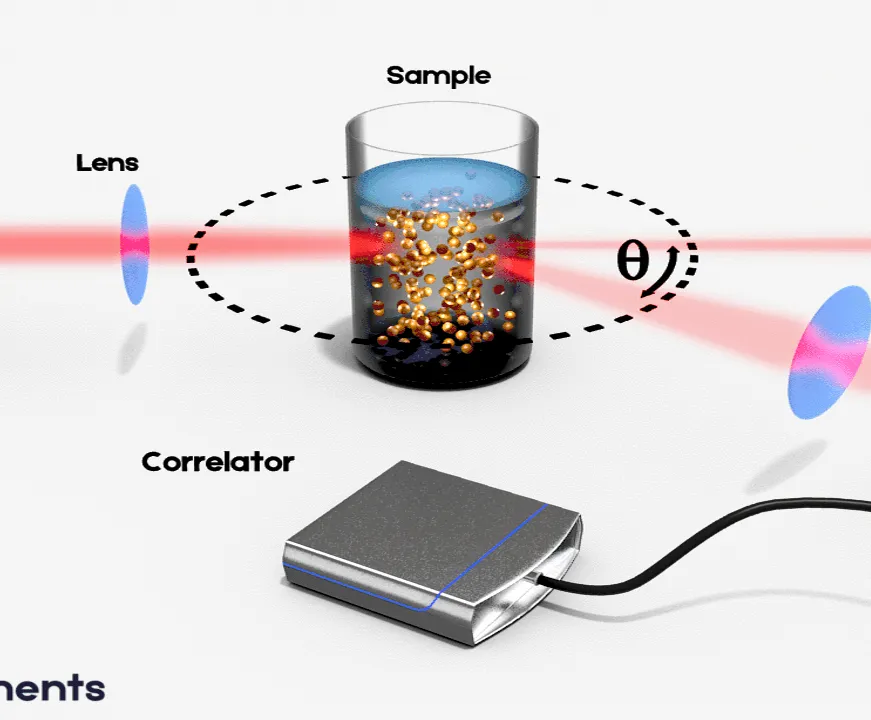
La dispersión de luz dinámica (DLS), también conocida como espectroscopia de correlación de fotones (PCS), es una herramienta muy poderosa para estudiar el comportamiento de difusión de macromoléculas en solución. El coeficiente de difusión y, por tanto, los radios hidrodinámicos calculados a partir de él, dependen del tamaño y la forma de las macromoléculas. Es una técnica que mide principalmente el movimiento Browniano de macromoléculas en solución que surge debido al bombardeo de moléculas solventes, y relaciona este movimiento con el tamaño de las partículas
Las biomoléculas como las proteínas a menudo presentan cambios conformacionales transitorios y reversibles, ensamblar y desensamblar rápidamente, reorganizar y reensamblado en su estado natural. Sus conformaciones naturales son importante para entender su función celular, y esencial para desarrollo farmacéutico. Las moléculas como los péptidos pueden ser difíciles de separar y analizar, ya que se equilibran rápidamente entre sus monómeros componentes y parcialmente formados ordenados o desordenados complejos, bajo condiciones fisicoquímicas específicas. Métodos que evaluan biomoléculas en equilibrio son indispensables.
En esto contexto, DLS es una poderosa técnica para estudiar las propiedades de suspensiones y soluciones de coloides, soluciones biológicas, macromoléculas y polímeros, es decir absoluta, no invasiva y no destructiva. Usamos el DLS para estudiar femonemos de agregación peptídica que tiene implicaciones en la actividad de ciertos PAMs, adicionalmente, usamos esta técnica para determinar o destacar diferentes mecanismos de acción de los PAMs (es decir, actividad de formación de poro o actividad tipo-detergente).
Ensayos de Fluidez de Membrana
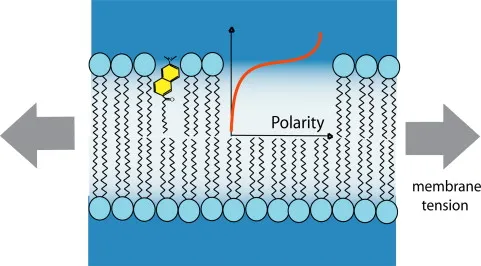
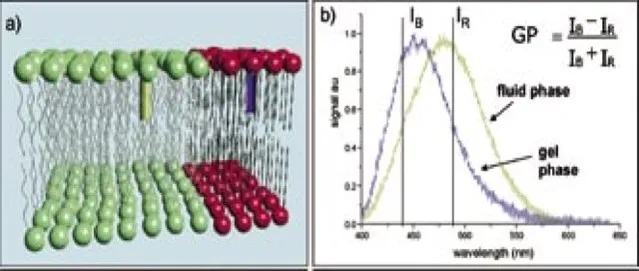
La fluidez de la membrana es uno de los principales determinantes de la difusión molecular en la membrana; por lo tanto, es crucial para bioactividad de la membrana. Una forma indirecta, pero directa, de inferir la fluidez de las membranas es utilizar sondas sensibles a la polaridad cuyas los espectros de emisión cambian con la polaridad del entorno. Polaridad en biomembranas generalmente refleja el nivel de hidratación de la bicapa. Los lípidos saturados forman membranas relativamente más apretadas donde la cadena hidrocarbonada puede volverse más ordenada. Además, hay menos moléculas de agua en la interfaz hidrofóbica/hidrofílica en comparación con las membranas compuestas de lípidos insaturados, que forman membranas empaquetadas relativamente sueltas.
Laurdan, una molécula fluorescente solvatocrómica que contiene 2-hidroxi-6-dodecanoil naftaleno, es un tinte sensible al medio ambiente que exhibe un gran cambio de Stokes correlacionado con la polaridad del entorno. Laurdan insertado en los modelos bicapa se encuentra en el interfase hidrofóbica/hidrofílica, y cambios en su fluorescencia espectros dan información valiosa sobre la estructura de la membrana y propiedades dinámicas, en particular en el nivel de empaquetamiento de lípidos y hidratación. Los valores de polarización generalizada (GP) son más altos en más membranas ordenadas que las desordenadas.
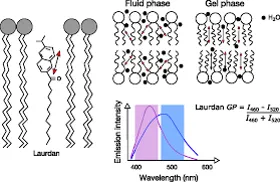
Estudios Monocapas de Langmuir
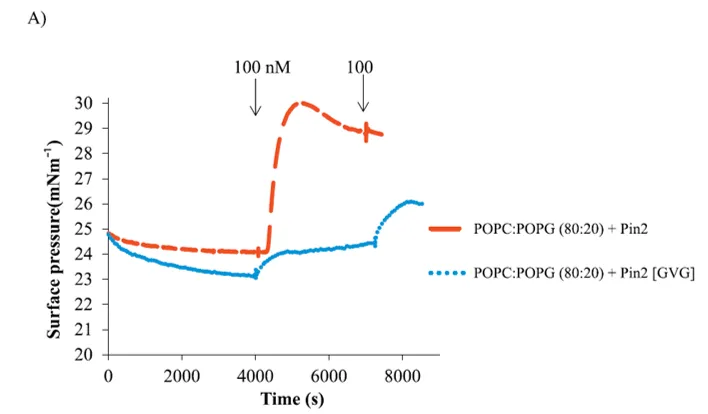
Las monocapas de lípidos en una interfase aire/agua proporcionan una solución simple y modelo sensible para imitar membranas biológicas, y muchos estudios han demostrado que la técnica monocapa es una poderosa herramienta para evaluar inserción en la membrana de proteínas y péptidos. Moléculas que interactúan sólo con los grupos de cabeza de la monocapa lipídica inducen cambios mínimas en la presión superficial. Mientras que las moléculas que interactúan con las cadenas acilo de los lípidos producen un aumento notable de superficie presión del sistema.

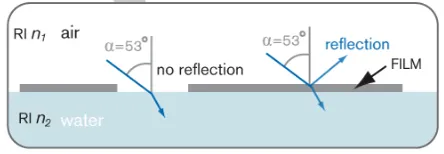
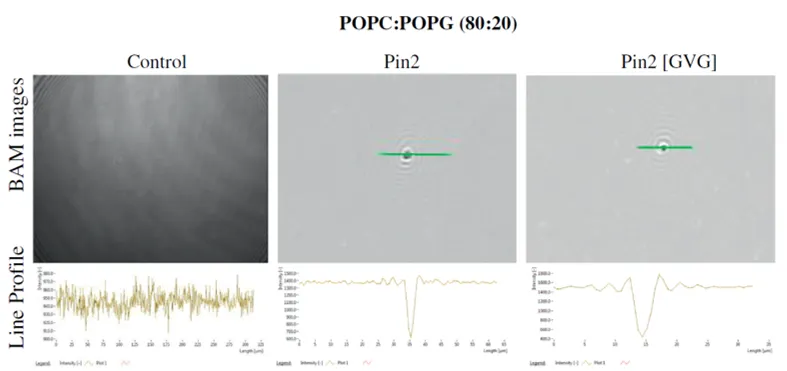
La microscopía del ángulo de Brewster (BAM) es una técnica de imagen basada en la reflexión de la luz en el ángulo de Brewster. Teóricamente, cuando una interfaz (generalmente agua-aire) es iluminada por un rayo láser colimado polarizado en el plano de incidencia en el ángulo de Brewster con respecto a la superficie, el rayo reflejado desaparecerá. En el ángulo de Brewster, la reflectividad es mínima, pero la reflectividad cambia si se coloca una película delgada (una película lipídica, por ejemplo) en la superficie del sustrato (un tampón, por ejemplo) como resultado de los cambios en el ángulo de Brewster interfacial.
BAM se considera una técnica poderosa que permite la visualización en tiempo real de las monocapas de Langmuir y, por lo tanto, se ha utilizado para complementar las mediciones tradicionales de presión superficial obtenidas con monocapas de Langmuir con imágenes. BAM se usa comúnmente para observar la morfología de la monocapa, la formación de dominios o la separación de fases.
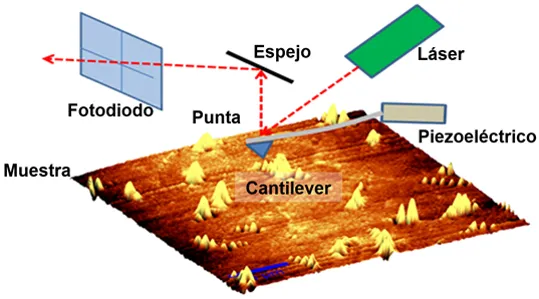
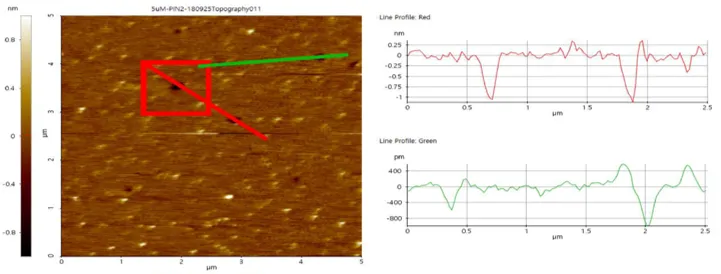
Microscopia de Fuerza Atómica
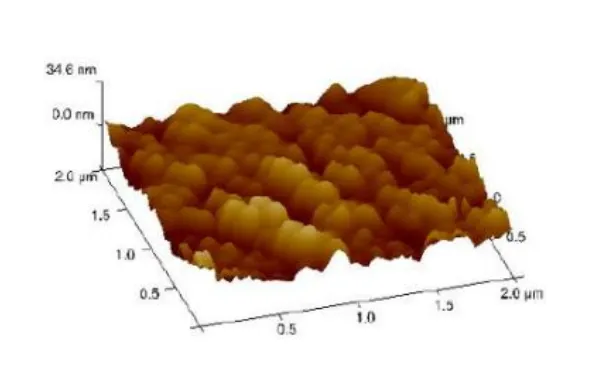
El microscopio de fuerza atómica es un instrumento mecano-óptico capaz de detectar fuerzas del orden de los nanonewtons. Al rastrear una muestra, es capaz de registrar continuamente su topografía mediante una sonda o punta afilada de forma piramidal o cónica.
AFM se ha convertido en una técnica establecida para obtener imágenes de lípidos planos bicapas, sin embargo, sólo se ha aplicado recientemente para determinar la mecanismo de acción de los AMP.
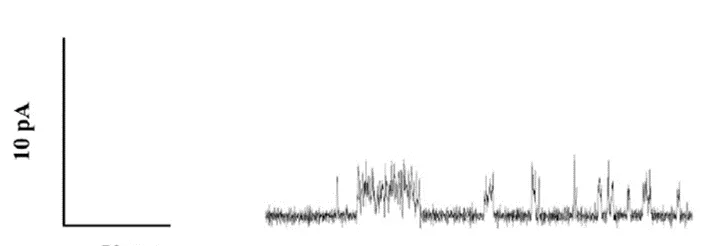
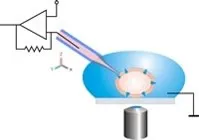
Electrofisiología
El enfoque de la electrofisiología es una estrategia que proporciona información de la relación de conductancia de poro-diámetro. La conductancia nos da una idea del número de iones que fluyen a través del poro y es inversamente proporcional a la resistencia (cuánto se limita el flujo de iones). La dinámica del flujo iónico es un reflejo de los cambios estructurales que ocurren en la estructura que regula el flujo; en las toxinas de los poros la amplitud es un reflejo del tamaño del poro.
Potencial de Membrana
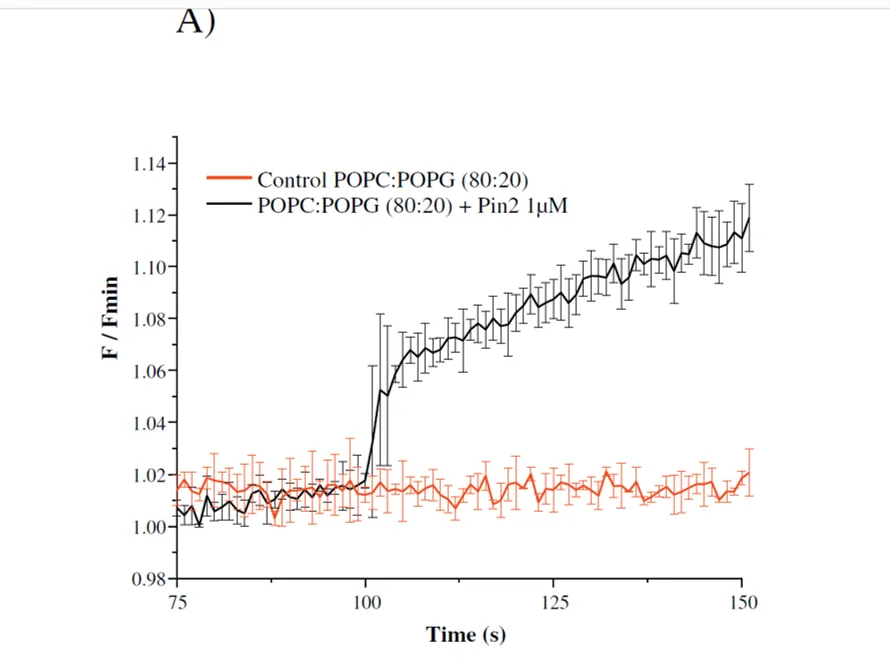
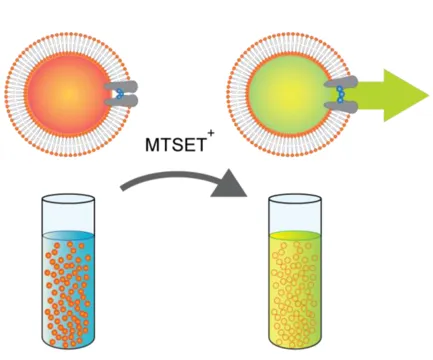
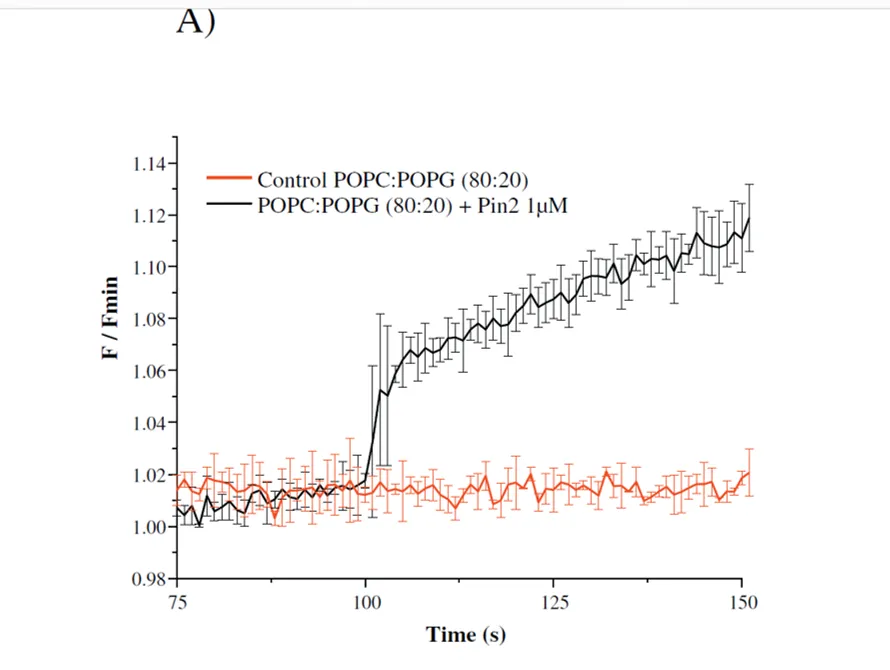
Sondas fluorescentes que detectan diferencias de potencial transmembranal se han utilizado ampliamente para detectar cambios rápidos en el potencial de membrana de células, orgánulos y vesículas.
La sensibilidad del fluorofo cianina al voltaje de la membrana depende del hecho de que tiene cargas deslocalizadas y se comporta como un catión permeable.
El potencial de membrana impulsa su distribución entre el interior de las vesículas y el medio. Cuando las vesículas están hiperpolarizadas, el colorante se acumula en su interior y por lo tanto la fluorescencia se apaga, debido a la formación de agregados de tinte. El tiempo de respuesta de la medida es corto, y cambios en el nivel de fluorescencia están directamente asociados a cambios en, usamos esta técnica para determinar o destacar diferentes mecanismos de acción de los PAMs (es decir, actividad de formación de poro o actividad tipo-detergente afecta el potencial de membrana inducido por el flujo iónico).
Simulación de Dinámica Molecular
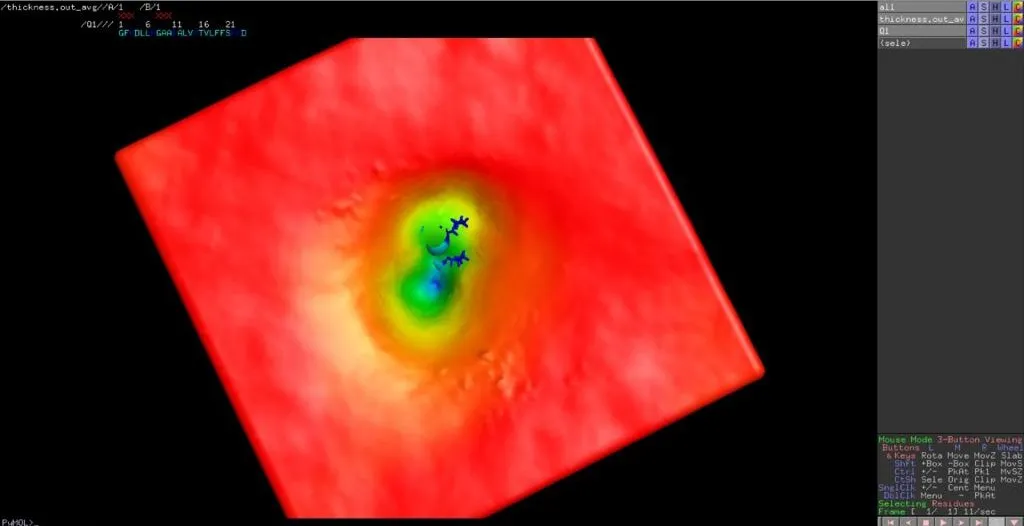
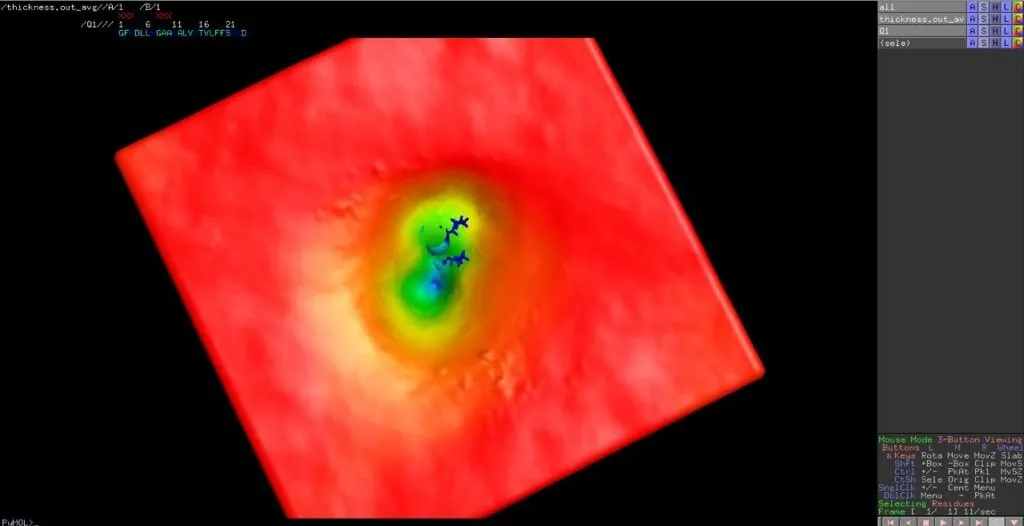
Actualmente, nos encontramos en medio de la revolución de la dinámica molecular (DM) in silico, que ha tenido un gran impacto en la forma en que entendemos la función de las proteínas. En particular, ha habido grandes avances en el campo de los péptidos activos de membrana, capturando con precisión la unión de péptidos (generalmente a través de interacciones electrostáticas), plegamiento (por ejemplo, de un estado desordenado a conformaciones de hélice alfa) e inserción en bicapas lipídicas; todo ello a escala atómica y con resolución espacial y temporal a escala nanométrica. Por lo tanto, no es de extrañar que los estudios MD sean actualmente la estrategia más popular para obtener información sobre los mecanismos moleculares de los péptidos que forman poros y, posteriormente, la formación y la dimensión de los poros.
Politica de Cookies
En este sitio utilizamos cookies propias y de terceros para mejorar nuestros servicios. Si continúa navegando, consideramos que acepta su uso.
Aceptar